Catedrático
Biotecnología de la Interacción de Microorganismos con Leguminosas y Otras Plantas de Interés Agrícola
Departamento de Microbiología, Facultad de Biología, Universidad de Sevilla (PAIDI BIO169)
Otros miembros
Líneas de investigación
- Regulación de la producción de señales moleculares bacterianas que participan en la interacción simbiótica rizobio-leguminosa.
- Determinación estructural de señales moleculares implicadas en la simbiosis rizobio leguminosa (factores Nod, polisacáridos superficiales bacterianos, flavonoides).
- Determinación del RNoma no codificante de Sinorhizobium fredii HH103 y Rhizobium tropici CIAT899 y estudio de su papel en la simbiosis con sus leguminosas hospedadoras.
- Sistemas de secreción bacterianos importantes en las relaciones bacteria-planta y bacteria-bacteria: T3SS y T6SS.
- Efectores rizobianos del T3SS implicados en la compatibilidad simbiótica con sojas salvajes y mejoradas.
- Papel de las vesículas de membrana rizobianas en la simbiosis con leguminosas.
- Ingeniería de vesículas extracelulares de membrana de bacterias rizosféricas para el desarrollo de biopesticidas y agentes promotores del crecimiento vegetal.
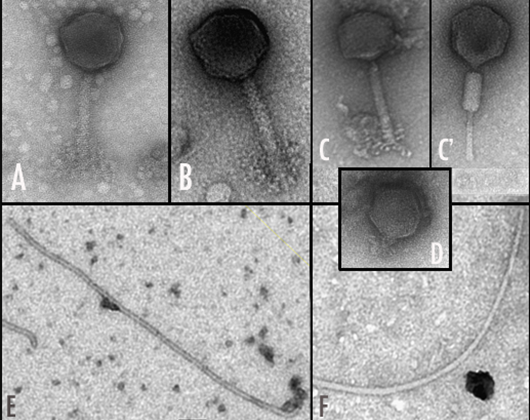
- Aislamiento y caracterización de bacteriófagos de rizobios.
- Mecanismos moleculares de control del crecimiento, la colonización o la infección de bacterias fitopatógenas en cultivos de interés agrícola.
- Genome-Wide Association Studies (GWAS) para estudiar la compatibilidad simbiótica de S. fredii HH103 con una población diversa de sojas salvajes y comerciales.
- Uso de herramientas de Inteligencia Artificial en diseño de proteínas para aumentar la compatibilidad simbiótica rizobio-leguminosa.
Publicaciones representativas
- Cook NM, Gobbato G, Jacott CN, Marchal C, Hsieh CY, Lam AHC, Simmonds J, del Cerro P, Navarro-Gomez P, Rodney C, Cruz-Mireles N, Uauy C, Haerty W, Lawson DM, Charpentier M. (2025). Autoactive CNGC15 enhances root endosymbiosis in legume and wheat. Nature 638, 752-759.
- Ayala-García P, Herrero-Gómez I, Jiménez-Guerrero I, Otto V, Moreno-de Castro N, Müsken M, Jänsch L, van Ham M, Vinardell JM, López-Baena FJ, Ollero FJ, Pérez-Montaño F, Borrero-de Acuña JM. (2025). Extracellular Vesicle-Driven Crosstalk between Legume Plants and Rhizobia: The Peribacteroid Space of Symbiosomes as a Protein Trafficking Interface. Journal of Proteome Research, 24(1), 94-110.
- Bernal P, Civantos C, Pacheco-Sánchez D, Quesada JM, Filloux A, Llamas MA. (2023). Transcriptional organization and regulation of the Pseudomonas putida K1 type VI secretion system gene cluster. Microbiology, 169(1), 001295.
- Fuentes-Romero F, Mercogliano M, De Chiara S, Alias-Villegas C, Navarro-Gómez P, Acosta-Jurado S, Silipo A, Medina C, Rodríguez-Carvajal MÁ, Dardanelli MS, Ruiz-Sainz JE, López-Baena FJ, Molinaro A, Vinardell JM, Di Lorenzo F. (2024). Exopolysaccharide is detrimental for the symbiotic performance of Sinorhizobium fredii HH103 mutants with a truncated lipopolysaccharide core. The Biochemical Journal, 481, 1621-1637.
- Reyes-Pérez PJ, Jiménez-Guerrero I, Sánchez-Reina A, Civantos C, Moreno-Castro N, Ollero FJ, Gandullo J, Bernal P, Pérez-Montaño F. (2025). The Type VI Secretion System of Sinorhizobium fredii USDA257 Is Required for Successful Nodulation With Glycine max cv Pekin. Microbial Biotechnology, 18(3), e70112.
- Acosta-Jurado S, Alías-Villegas C, Navarro-Gómez P, Almozara A, Rodríguez-Carvajal MA, Medina C, Vinardell JM (2020). Sinorhizobium fredii HH103 syrM inactivation affects the expression of a large number of genes, impairs nodulation with soybean, and extends the host‐range to Lotus japonicus. Environ Microbiol. 22: 1104-1124. https://doi.org/10.1111/1462-2920.14897.
- Jiménez-Guerrero I, Acosta-Jurado S, Medina C, Ollero FJ, Alias-Villegas C, Vinardell JM, Pérez-Montaño F, López-Baena FJ. (2020). The Sinorhizobium fredii HH103 Type III secretion system effector NopC blocks nodulation with Lotus japonicus J Exp Bot. 71: 6043-6056. https://doi.org/10.1093/jxb/eraa297.
- Bernal P, Furniss RCD, Fecht S, Leung RC, Spiga L, Mavridou DA, Filloux, A. (2021) A novel stabilization mechanism for the Type VI secretion system sheath. Natl. Acad. Sci. USA 118:e2008500118. https://doi.org/10.1073/pnas.2008500118.
- de la Osa C, Rodríguez-Carvajal MÁ, Gandullo J, Aranda C, Megías M, Ollero FJ, López-Baena FJ, Monreal JA. (2021) Plant growth-promoting rhizobacteria modulate the concentration of bioactive compounds in tomato fruits. Separations 8:223. https://doi.org/10.3390/separations8110223.
- Alias-Villegas C, Fuentes Romero F, Cuéllar V, Navarro-Gómez P, Soto MJ, Vinardell JM, Acosta-Jurado S. (2022) Surface motility regulation of Sinorhizobium fredii HH103 by plant flavonoids and the NodD1, TtsI, NolR, and MucR1 symbiotic bacterial regulators. 2022. Int. J. Mol. Sci. 23, 7698. https://doi.org/10.3390/ijms23147698.
- Navarro-Gómez P, Fuentes-Romero F, Pérez-Montaño F, Jiménez-Guerrero I, Alías-Villegas C, Ayala-García P, Almozara A, Medina C, Ollero FJ, Rodríguez-Carvajal MÁ, Ruiz-Sainz JE, López-Baena FJ, Vinardell JM, Acosta-Jurado S. (2023) A complex regulatory network governs the expression of symbiotic genes in Sinorhizobium fredii Front Plant Sci. 14:1322435. https://doi.org/10.3389/fpls.2023.1322435.
Proyectos
- Francisco Pérez Montaño. Mejora de la resiliencia de los cultivos a través de interacciones planta-microorganismo. Universidad de Sevilla. 2025/00000660. 01/06/2025-31/05/2026.
- Estudios de mecanismos de regulación alternativos para la síntesis de señales simbióticas en rizobios. PID2022-141156OB-I00. 01/09/2023 – 31/08/2026
- Mejorando el diálogo simbiótico a través de vesículas de membrana rizobianas. PID2021-122395OA-I00. 01/09/2022 – 31/08/2026
- Engineering extracellular membrane vesicles from rhizospheric bacteria for the development of biopesticides and plant-growth promoting agents. PROYEXCEL_00450. 02/12/2022 – 31/12/2025.
- Señalización sistémica en la simbiosis rizobio-leguminosa y nutrición nitrogenada. Efectos sobre la productividad vegetal. PID2021-122353OB-I00. 01/09/2022 – 31/08/2025
Métodos destacados
| EQUIPO | METODOLOGÍA |
| 1. Thermo scientific liquid chromatography system. | Determinación de factores de nodulación. |
| 2. Nanosight ns300 marvern panalitycal nanoparticle analyzer. | Aislamiento de vesículas extracelulares de membrana. |
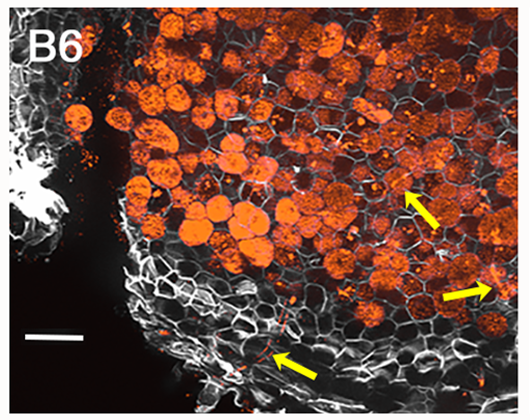
| 3. Zeiss fluorescence apotome.2 microscope. | Visualización del progreso de la infección: colonización, tubos de infección y nódulos. Localización de proteínas e interacción entre proteínas en hojas de tabaco. |
| 4. Cromatógrafo de gases. | Cuantificación de la fijación de nitrógeno por ARA (acetylene reduction assay) |
Colaboraciones con otros grupos nacionales e internacionales
- David S. Guttman – University of Toronto, Canadá
- Dieter Jahn – Technischen Universität Carolo-Wilhelmina Zu Braunschweig, Alemania
- Sussane Sievers – Universität Greifswald, Alemania
- Federico Martinelli – Università Degli Studi di Firenze, Italia
- Ignacio Poblete Castro – Universidad de Santiago de Chile
- Saul Burdman – The Hebrew University of Jerusalem, Israel
- Maria Camacho Martinéz Vara Del Rey – IFAPA, España
- Alessio Mengoni – Università Degli Studi di Firenze, Italia
- José Ignacio Jiménez Zurdo – Estación Experimental del Zaidín, España
- María José Soto Misfutt – Estación Experimental del Zaidín, España
- Myriam Charpentier – John Innes Centre, Reino Unido
- Juan Sanjuan Pinilla – Estación Experimental del Zaidín, España
- Jens Stougaard – Aarhus Universitet, Dinamarca
- Flaviana Di Lorenzo – Università Degli Studi Di Napoli, Italia
- Mariangela Hungria – EMBRAPA Soja, Brasil
- Thomas Martin – Universidade Federal de Santa Maria, Brasil
- Alain Filloux – Imperial College of London, Reino Unido
- Despoina Mavridou – University of Texas at Austin, EEUU
- George diCenzo – Queen’s University, Kingston, Ontario, Canadá
- Chang-Fu Tian – China Agricultural University, Beijing, China
- Zhen-Tao – Heilongjiang Academy of Sciences, Harbin, China
- Peter Kaló – Institute of Plant Biology, HUN-REN Biological Research Centre, Szeged, Hungría